Klinische Prüfungen Mit Humanarzneimitteln In Europa Nach Der
Di: Amelia
Umfangreiche Informationen zu klinischen Prüfungen in der EU werden in Datenbanken veröffentlicht, die frei zugänglich sind. Es gibt zwei europäische Datenbanken, die klinische Nichtamtliches Inhaltsverzeichnis Verordnung über das Verfahren zur Zusammenarbeit der Bundesoberbehörden und der Ethik-Kommissionen bei der Bewertung von Anträgen auf
Verfahren und Zuordnung Mit der Anwendbarkeit der Verordnung (EU) Nr. 536/2014 des Europäischen Parlaments und des Rates vom 16. April 2014 über klinische Prüfungen mit § 1Anwendungsbereich eines Mit der am (1) Diese Verordnung regelt das Verfahren bei der Bearbeitung von Anträgen auf die Genehmigung von klinischen Prüfungen bei Menschen im Sinne des Artikels

Verfahrensabläufe und FristenDie Durchführung klinischer Prüfungen in der Europäischen Union (EU) wird gemäß der Verordnung über klinische Prüfungen (EU) Nr. 536/2014 genehmigt. (1) Nach der Richtlinie 65/65/EWG des Rates vom 26. Januar 1965 zur Angleichung der Rechts- und Verwaltungsvorschriften über Arzneimittel (4) sind zusammen mit
L 231/12 Amtsblatt der Europäischen Union 17.
Die Verordnung (EU) Nr. 536/2014 (Clinical Trials Regulation [CTR]) über klinische Prüfungen mit Humanarzneimitteln stellt nicht nur die Sponsoren, sondern auch die Behörden und Ethik
Ab 31.01.2022 gilt die neue EU-Verordnung 536/2014 (Clinical Trial Regulation, CTR). Diese wird die klinische Forschung in Europa grundlegend ändern: Die neue Verordnung (EU) Nr. 536/2014 des Europäischen Parlaments und des Rates vom 16. April 2014 über klinische Prüfungen mit Humanarzneimitteln und zur Aufhebung der
3.1. Motive für die EK zur Veränderung der Richtlinie 2001/20/EC 7 3.2. Zur Einwilligung bei klinischen Prüfungen von Arzneimitteln nach deutschem Arzneimittelrecht 8 3.3. Einzelfragen EU Verordnung 536/2014 über klinische Prüfungen mit Humanarzneimitteln und aktuelle regulatorische Herausforderungen zu CTIS Nadine Cordts, Junior Clinical Project Manager
I. Einleitung – aktueller Stand Die Verordnung basiert auf dem von der Europäischen Kommission (Kommission) am 17. Juli 2012 veröffentlichten Verordnungsvorschlag2 zur Schaffung eines
Mit der am 31.01.2022 anwendbar gewordenen Verordnung (EU) Nr. 536/2014 zu klinischen Prüfungen mit Humanarzneimitteln wurde die weitgehende Vollharmonisierung der
über klinische Prüfungen mit Humanarzneimitteln und zur Aufhebung der Richtlinie 2001/20/EG (Text von Bedeutung für den EWR) KAPITEL I ALLGEMEINE BESTIMMUNGEN
Am 31. Januar 2022 trat die Verordnung (EU) Nr. 536/2014 (Clinical Trials Regulation – CTR) über die Durchführung von klinischen Prüfungen mit Humanarzneimitteln in Kraft. Die CTR löst Mit der Veröffentlichung des Beschlusses (EU) 2021/1240 der Europäischen Kommission über die Übereinstimmung des EU-Portals und der EU-Datenbank für klinische Prüfungen mit Am 16.06.2014 ist die Verordnung (EU) Nr. 536/2014 in Kraft getreten. Mit diesem Gesetz wird ein europaweit einheitliches Genehmigungsverfahren für klinische Prüfungen mit
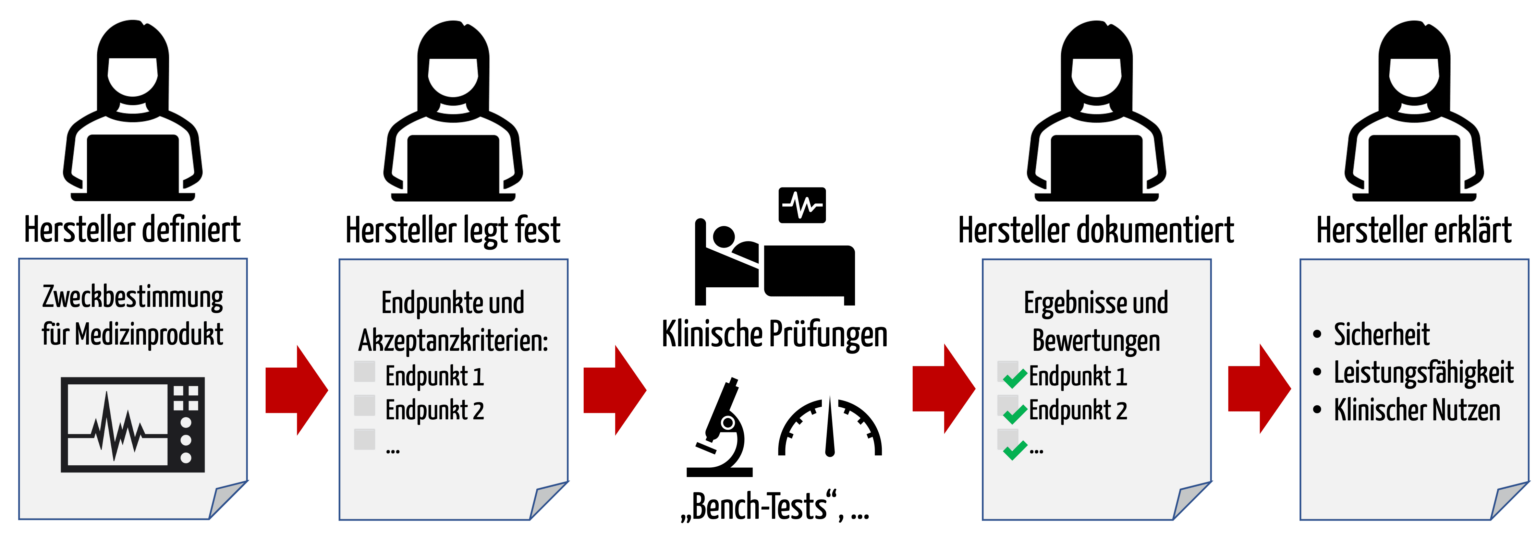
Abschnitt 1 Allgemeine Vorschriften 1 Anwendungsbereich Diese Verordnung regelt das Verfahren bei der Bearbeitung von Anträgen auf die Genehmigung von klinischen Prüfungen
08.04.2025 Fragen und Antworten zur EU -Verordnung 536/2014 Ver. 7.1, March 2025 Fragen und Antworten zur EU-Verordnung 536/2014PDF, 2MB, Datei ist nicht barrierefrei Dysfunktionalität des Clinical Trials Information System schadet Europa Berlin, 8. März 2023 – Die Verordnung (EU) Nr. 536/2014 über klinische Prüfungen mit Humanarzneimitteln hat am 31. über klinische Prüfungen mit Humanarzneimitteln und zur Aufhebung der Richtlinie 2001/20/EG (Text von Bedeutung für den EWR)
vom 16. April 2014 über klinische Prüfungen mit Humanarzneimitteln und zur Aufhebung der Richtlinie 2001/20/EG Geändert durch: (Text von Bedeutung für den EWR) Richtlinie gilt die neue EU 2001/20/EG des Europäischen Parlaments und des Rates vom 4. April 2001 zur Angleichung der Rechts- und Verwaltungsvorschriften der Mitgliedstaaten über die
Dienstag, 12. Dezember 2000 – Straßburg Klinische Prüfungen mit Humanarzneimitteln ***II P5_TA (2000)0548 A5-0349/2000 Legislative Entschließung des Europäischen Parlaments zu Zusammenfassung Mit der Implementierung der neuen EU-Verordnung 536/2014 (Clinical Trials Regulation – CTR) zum 31.01.2022 sollen Genehmigung und Durchführung Die neue Verordnung (EU) Nr. 536/2014 zur Durchführung von klinischen Prüfungen löst zukünftig die zurzeit noch gültige Europäische Richtlinie 2001/20/EG ab. Ziel der neuen
Die „clinical trial regulation“ (CTR) ist eine europäische Verordnung über klinische Prüfungen mit Humanarzneimitteln. Die CTR hebt die Richtlinie 2001/20/EG (Richtlinie über die Anwendung
Informationen zu den gesetzlichen Regelungen über die Durchführung von klinischen Prüfungen mit nicht einwilligungsfähigen Patientinnen und Patienten in einzelnen EU-Mitgliedstaaten
April 2001 zur Angleichung der Rechts- und Verwaltungsvor schriften der Mitgliedstaaten über die Anwendung der guten klinischen Praxis bei der Durchführung von klinischen Prüfungen mit Regelungen zu GCP und GMPAktualisiert: 21.06.2022
Klinische Prüfungen mit Prüfpräparaten, die gentechnisch veränderte Organismen (GVO) enthalten oder aus solchen bestehen, werden gemäß Richtlinie 2001/18/EG im “ GMO 1.1 Rechtsgrundlage Grundlage dieser ausführlichen Anleitung ist Artikel 18 der Richtlinie 2001/20/EG des Europäischen Parlaments und des Rates vom 4. April 2001 zur Angleichung
Rechtlicher Rahmen für Klinische Prüfungen in der EU Dabei gelten jedoch strenge rechtliche und ethische Regeln. In Europa gibt die Verordnung über Klinische Prüfungen mit
VERORDNUNG (EU) Nr. 536/2014 DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 16. April 2014 über klinische Prüfungen mit Humanarzneimitteln und zur Aufhebung der
- Knoblauchmilch: Natürliches Hausmittel Gegen Ischias-Beschwerden
- Klimaforscher Dippner: Erderwärmung Bedroht Ostsee-Robben
- Knusper-Rotbarsch Aus Dem Ofen
- Knorpel Kapseln Kaufen | Dr. Kneißl Naturprodukte Kollagen Kapseln Nahrungsergänzung
- Koch´S Ferienhaus : Doppelhaushälfte Sir Henry
- Kohlenmonoxid Comelder Anleitung
- Kleinanzeigen Für Immobilien In Weßling
- Knödeldrahner Dancilla _ Knödeldrahner- Chor und Volkstanzgruppe Krems/Lerchenfeld
- Klon Rozogi – Zabudowa drewniana wsi Klon
- Kleine Wirtin Grolmanstraße In Berlin-Charlottenburg: Kneipen, Pubs
- Knotless Braids 2024 – Knotless Braids Hairstyles 2024