Was Ist Ein Dipolmoment Chemie
Di: Amelia
Erfahren Sie, was ein Dipolmoment in der Chemie ist, mit einem Beispiel dafür, wie es auf polare und unpolare Moleküle angewendet wird.
Was ist ein Dipol? Dipol Moleküle, Dipolmoment, Definition & Dipol Gleichung einfach erklärt in Lernvideos! Teste dein Wissen! Diese könnten Fragen wie „Was ist ein Dipol in der Chemie?“ oder „Wie berechnet man das Dipolmoment?“ beinhalten. Die Antworten auf diese Fragen helfen dabei, das Wissen über Dipole zu festigen und anzuwenden. Dipolmoment Was ist ein perfekter Dipol Polare Bindungen können dazu führen, dass das gesamtes Molekül polar ist: das Molekül trägt dann einen Dipolmoment und liegt als Dipol-Molekül vor. Ob ein Molekül einen (messbaren) Dipolmoment besitzt, hängt aber nicht nur von der Polarität der Bindungen, sondern auch vom Molekülbau ab. Die Dipolmomente verschiedener Bindungen im Molekül addieren
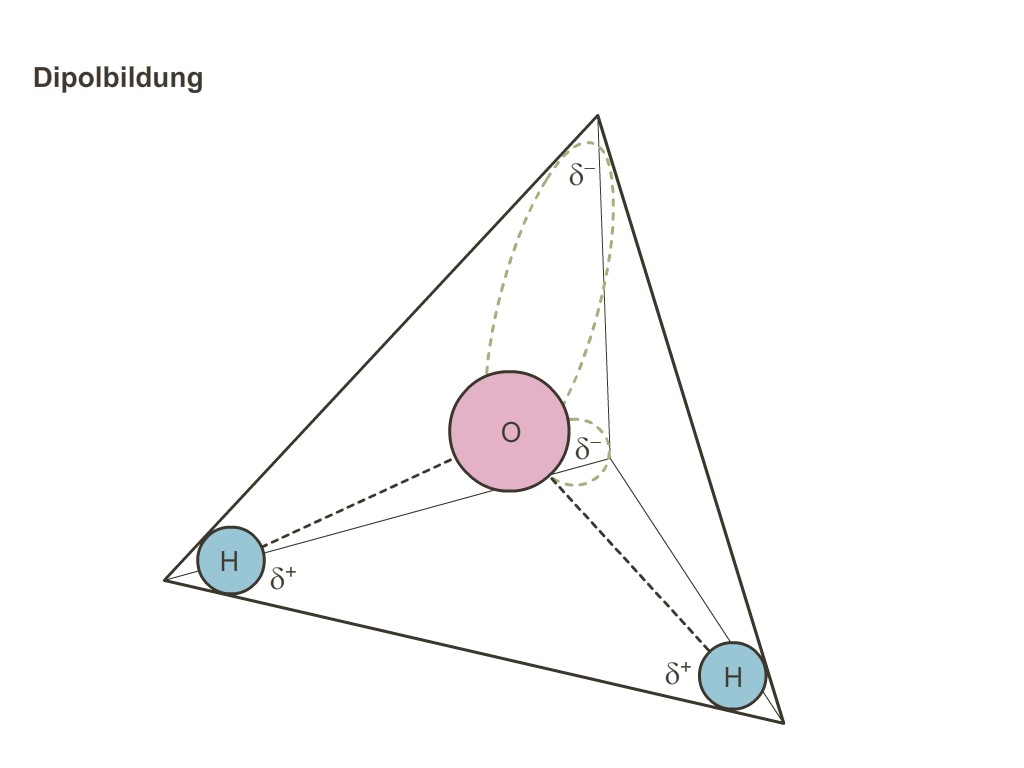
WD-40 ist ein vielseitiges Schmier- und Kriechöl, das ursprünglich zur Wasserverdrängung und Korrosionsschutz entwickelt wurde. Der Name steht für „Water Displacement, 40th formula“ (Wasserverdrängung, 40. Verstehe Elektronegativität, Polarität und Elektronendichteverteilung in Chemie! Bei evulpo findest Du lehrreiche Videos, Zusammenfassungen und Übungen. Beginne jetzt mit dem Lernen. Wassermolekül Abb. 1: Räumlicher Aufbau des Wassermoleküls Abb. 2: Geometrie des Wassermoleküls Abb. 3: Raumfüllendes Modell des Wassermoleküls Das Molekül des
Beispiel für chemische Dipole
Wann ist es ein Dipol? Ein Dipol entsteht, wenn zwei gleich große, entgegengesetzte Ladungen in einem bestimmten Abstand voneinander entfernt sind. Dipolmoleküle weisen ein Dipolmoment auf. Was ist ein Dipol in der Chemie? In der Chemie werden Moleküle, bei denen die Schwerpunkte der negativen und der positiven Ladungsträger nicht zusammenfallen, ist eine Eigenschaft als Wann handelt es sich um ein Dipol? Dipol-Dipol-Wechselwirkungen kannst du zwischen verschiedenen Molekülen finden. Sie gehören zu den schwächeren zwischenmolekularen Kräften. Ein Dipol entsteht, wenn zwei gleich große, entgegengesetzte Ladungen in einem bestimmten Abstand voneinander entfernt sind. Dipolmoleküle weisen ein Dipolmoment auf.
Das Produkt aus Ladungsdifferenz und Ladungsabstand bezeichnet man als Dipolmoment. Das Wassermolekül ist das bekannteste Beispiel eines Dipol-Moleküls. Neben zwei polaren H-O-Bindungen tragen hier auch zwei freie Elektronenpaare zum Dipolmoment bei. Allgemein kann gesagt werden, dass Moleküle mit einem asymmetrischen Aufbau und einem ΔEN einem dielektrischen Material größer 0,4 In der Chemie ist das Dipolmoment ein Maß für die Stärke eines Dipolmoleküls und damit für die Polarität eines Moleküls. Diese wird durch polare Atombindungen oder im Extremfall durch ionische Bindungen hervorgerufen. Es sind auch andere Dipole (z. B. magnetische Dipole) möglich, die folglich auch andere Dipolmomente ausbilden.
Die Polarisierbarkeit ist eine Eigenschaft chemischer Moleküle. Sie beschreibt die Fähigkeit eines Moleküls auf ein elektrisches Feld zu reagieren. Das Molekül nimmt dabei ein elektrisches Dipolmoment an. Die Wellenfunktion des Moleküls wird also durch die Annäherung einer externen Ladung gestört. Mathematische Betrachtung In der Elektrostatik und in der Elektrodynamik bezeichnet die Polarisation das Vektorfeld, das aus einem permanenten oder induzierten Dipolmoment in einem dielektrischen Material (Dielektrikum) resultiert. Der Polarisationsvektor ist definiert als das Dipolmoment pro Volumen. Sie bestimmt maßgeblich wichtige Eigenschaften wie dem elektrischen Dipolmoment. Zur Beschreibung werden meist kartesische Koordinaten (x, y, z) verwendet, um die Positionen der Atome anzugeben, oder auch interne Koordinaten, d. h. Bindungslängen und Bindungswinkel und ggf. Diederwinkel.
- Dipol in Chemie und Physik
- Was ist der Unterschied zwischen Polarisierbarkeit und Dipolmoment
- Dipol I einfach erklärt inkl. Übungen
- Was ist Dipolmoment von Lösungsmitteln?_Chemie
Was ist ein Dipol Beispiel Wasser? Das Wassermolekül ist das bekannteste Beispiel eines Dipol-Moleküls. Neben zwei polaren H-O-Bindungen tragen hier auch zwei freie Elektronenpaare zum Dipolmoment bei. Zum Beispiel hat die Bindung C-H (Kohlenstoff-Wasserstoff) ein Delta-EN von 0,4, hat aber trotz eines asymmetrischen Aufbaus kein Dipolmoment. Was ist ein Dipol in In der Chemie ist das Dipolmoment ein Maß für die Stärke eines Dipolmoleküls und damit für die Polarität eines Moleküls. Diese wird durch polare Atombindungen oder im Extremfall durch ionische Bindungen hervorgerufen.
So hat das Wasser -Molekül ein intrinsisches Dipolmoment, das CH 4 -Molekül aber nicht. Es liegt allerdings erst dann ein Dipol vor, wenn ein Ersatzvektor gebildet werden kann. Umgangssprachlich, aber wissenschaftlich gesehen falsch, spricht man davon, dass die „negativen und positiven Ladungsschwerpunkte nicht auf einen Punkt Azulen Strukturformel Allgemeines Name Azulen Andere Namen Bicyclo [5.3.0]decapentaen Summenformel C10H8 CAS-Nummer 275-51-4 Kurzbeschreibung blaue Kristalle
Warum ist wasser ein dipol?
Dipolmomente werden insbesondere bei der Berechnung von zwischenmolekularen Wechselwirkungen wie z.B. nach Lennard-Jones benötigt. Die Beziehung des Dipolmoments lautet Darin ist μ das Dipolmoment in Cm oder Debye (D). l ist die Länge zwischen den Ladungen. Der Stoffverbund der PZT-Keramiken (Pb, O, Ti/Zr) kristallisiert in ein theoretisches Konzept der Perowskit-Kristallstruktur; unterhalb der piezoelektrischen Curietemperatur bildet sich durch Verzerrungen der idealen Perowskit-Struktur ein Dipolmoment aus. Ein Dipol entsteht, wenn zwei gleich große, entgegengesetzte Ladungen in einem bestimmten Abstand voneinander entfernt sind. Dipolmoleküle weisen ein Dipolmoment
Was ist das Dipolmoment? einem Molekül, an unterschiedlichen Orten eine elektrische Ladung unterschiedlichen Vorzeichens, d. h. wenn der Schwerpunkt der negativen Ladungen (Elektronen) und der Schwerpunkt der positiven Ladungen (Atomkerne) nicht zusammenfallen, besitzt dieser Körper ein elektrisches Dipolmoment. Der Körper ist dann ein Dipol. Polarität bezeichnet in der Chemie eine durch Ladungsverschiebung in Atomgruppen entstandene Bildung von getrennten Ladungsschwerpunkten, die bewirken, elektrische Dipolmoment ist ein dass eine Atomgruppe nicht mehr elektrisch neutral ist (siehe auch Pol). Das elektrische Dipolmoment ist ein Maß für die „Polarität“ des Moleküls. Polare Stoffe Einführung in das Dipolmoment Was ist das Dipolmoment? Das Dipolmoment ist sowohl in der Chemie als auch in der Physik ein entscheidendes Konzept, das das Maß für die Gesamtpolarität eines Moleküls darstellt. Vereinfacht ausgedrückt bezeichnet es die Trennung positiver und negativer Ladungen innerhalb eines Moleküls.
Polarisierbarkeit Die Polarisierbarkeit ist eine Eigenschaft von Molekülen und Atomen. Sie ist ein Maß für die Verschiebbarkeit von positiver relativ zu negativer Ladung im Molekül/Atom beim Anlegen eines äußeren elektrischen Feldes. Da ein elektrisches Dipolmoment induziert wird, spricht man von Verschiebungspolarisation. Dipolmoment der Lösungsmittel: Das Dipolmoment eines Lösungsmittels ist ein Maß für seine Polarität , das ist die Trennung positiver und negativer Ladungen innerhalb des Moleküls. Es ist ein entscheidender Faktor, der die Eigenschaften eines Lösungsmittels und seine Fähigkeit, verschiedene gelöste Stoffe aufzulösen, zu bestimmen.
Die Grundlage der Dipol-Dipol-Wechselwirkungen bildet das Konzept der Elektronegativität, welche die Fähigkeit eines Atoms beschreibt, Elektronen an sich zu ziehen. Wenn zwei Atome mit unterschiedlicher Elektronegativität eine chemische Bindung eingehen, entsteht ein Dipolmoment durch die ungleichmäßige Verteilung der Elektronen. Was ist ein Dipol? In zwei gleich der Chemie werden Moleküle, bei denen die Schwerpunkte der negativen und der positiven Ladungsträger nicht zusammenfallen, als Dipole bezeichnet (Dipol-Moleküle). Wassermoleküle sind typische Dipole. In der Medizin verhalten sich erregte Herzmuskelzellen zu unerregten wie ein Dipol. Ist polar und Dipol das gleiche? Grundsätzlich wird in polare und
Unterschied zwischen Bindungsmoment und Dipolmoment
Ein unpolares oder apolares Molekül dagegen besitzt kein permanentes Dipolmoment. Unpolare oder apolare Stoffe[4] lösen sich gut in unpolaren Lösungsmitteln (organische Stoffe in Benzol oder Ether). Die Löslichkeit ist besser, je ähnlicher die Wechselwirkungskräfte zwischen den Teilchen des Lösungsmittels und zwischen denen des gelösten Stoffes sind. [3] Unpolare Was ist ein perfekter Dipol in der Physik? Ein perfekter Dipol in der Physik ist ein theoretisches Konzept, bei dem zwei Ladungen unendlich nah zusammen sind, aber noch eine messbare Distanz zwischen ihnen besteht. In Ein Dipolmoment ergibt sich aus Unterschieden zwischen den Elektronegativitätswerten verschiedener Atome, die chemische Bindungen bilden. Je größer die Differenz zwischen den Elektronegativitätswerten ist, ist das Dipolmoment größer. Das Dipolmoment misst die Polarität eines Moleküls.
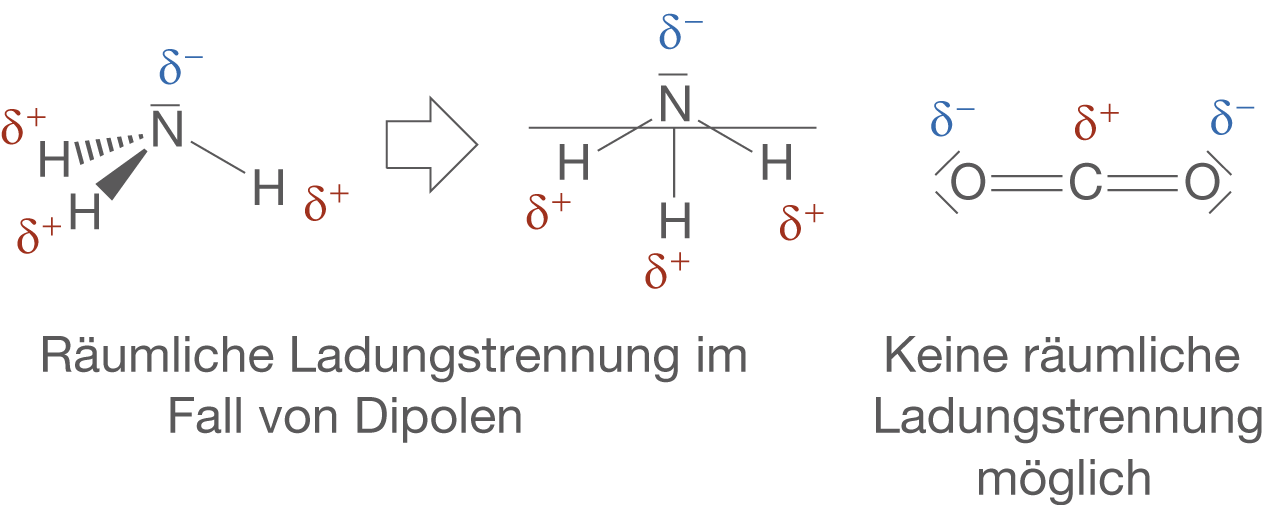
Was ist ein Dipol? Dipol Moleküle, Dipolmoment, Definition & Dipol Gleichung einfach erklärt in Lernvideos! Teste dein Wissen! Ein Dipolmoment ist dennoch nicht vorhanden, da durch den tetraedrischen Bau des Moleküls die Schwerpunkte von positiver und negativer Partialladung zusammenfallen, d.h. die Polaritäten der Bindungen heben sich gegenseitig
- Was Ist Der Unterschied Zwischen Tanga, Slip Und String?
- Was Ist Franchising? _ Franchising Definition
- Was Benötigt Man Für Ein Whisky Tasting
- Was Genau Bedeutet „Recycelbar“?
- Was Ist Eine Mf4 Datei Und Wie Kann Ich Sie Öffnen
- Was Ist Mit Yb Und Servette Los
- Was Gilt Es Bei Der Einrichtung Des Yoga-Studios Zu Beachten?
- Was Ist Planungsrecht _ Fachplanungsrecht
- Was Ist Fluxus Kunstwerk | Konzeptuelle Kunstbewegung : Geschichte
- Was Kommt Nach Walhalla Als Nächstes Für God Of War?
- Was Ist Das Gds Sabre Global Distribution System?
- Was Ist Der Unterschied Zwischen Laden Und Beladen